1、产品名称:一次性使用人体静脉血样采集容器
2、型号:
2.1玻璃管:无添加剂、促凝剂、分离胶/促凝剂、EDTAK2、EDTAK3、氟化钠、柠檬酸钠9:1、柠檬酸钠4:1、肝素钠、肝素锂。
2.2塑料(PET)管:无添加剂、促凝剂、分离胶/促凝剂、EDTAK2、EDTAK3、氟化钠、柠檬酸钠9:1、柠檬酸钠4:1、肝素钠、肝素锂、EDTAK2/分离胶。
3、规格:0.5ml、1ml、1.6ml、1.8ml、1.28ml、2ml、3ml、4ml、5ml、6ml、7ml、10ml。
二.注册人名称、住所、联系方式及服务单位:
1、注 册 人:郑州山山医疗用品有限公司 电 话:0371-67839333
2、住 所:郑州市中牟县官渡工业园区辉煌三路南、金菊三街东
3、服务单位:郑州山山医疗用品有限公司
三.生产企业名称、住所、生产地址、联系方式及生产许可证编号:
1、企业名称:郑州山山医疗用品有限公司
2、住 所:郑州市中牟县官渡工业园区辉煌三路南、金菊三街东
3、生产地址:郑州市中牟县官渡工业园区辉煌三路南、金菊三街东
4、联系电话:0371-67839333
5、售后服务:0371-67839333 邮编:451450
6、医疗器械生产许可证编号:豫食药监械生产许20160006号
四.医疗器械注册证编号:豫械注准20202221199
五.产品技术要求编号:豫械注准20202221199
六.产品性能、主要结构组成或者成分、适用范围:
1、产品性能:
1.1外观
1.1.1 采血管管子应透明,内外表面光滑,无裂缝、杂质、毛刺或粗糙表面。
1.1.2 塑料盖帽应完整、无毛边、无缺损和明显杂质。
1.1.3 丁基胶塞应完整、无毛边、无缺损、韧性好。
1.2 抽吸体积
按YY 0314-2021附录A或附录B规定的方法试验时,水的体积应在抽吸体积的90%~110%以内(取刻度块的下线)。如果不满足抽吸体积的90%~110%的要求,制造商应确保能获得正确的结果。
1.3设计
1.3.1按YY0314-2021附录C规定的方法或其他等效方法进行容器泄漏试验时,头盖不应松动;采集容器侵入的水中不应检测出荧光。
1.3.2 当头盖预期取下时,其设计应能用手指和(或)机械装置握住后取下,而手指或机械装置不能触及到头盖与血样接触的部分。
1.4结构
1.4.1按YY0314-2021附录D规定的方法进行试验,装有试样的采集容器在3000g相对离心力(RCF)下离心时,应无破碎、裂缝或泄露。
1.4.2以目力检验时,采集容器不应有能让使用者的皮肤受到意外划伤、刺破或擦伤的锐边、毛刺或粗糙表面。
1.5无菌
1.5.1真空采集容器,如果未使用过,内部应无菌。产品采用钴-60灭菌。
1.5.2非真空采集容器,未打开和未使用过的采集容器内部应无菌。
1.6 添加剂及添加物
1.6.1 EDTAK2、EDTAK3、EDTA Na2
EDTA K2、EDTA K3每毫升血液中EDTA浓度应为1.5mg~2.2mg;EDTA Na2每毫升血液中EDTA含量应为1.4mg~2.0mg。
1.6.2柠檬酸钠
柠檬酸钠抗凝剂浓度应为(100~136)mmol/L。采集容器内添加剂溶液的体积允差应为10%。柠檬酸钠9:1是1体积的柠檬酸钠溶液应添加9体积的血液。柠檬酸钠4:1是1体积的柠檬酸钠溶液应添加4体积的血液。
1.6.3肝素钠、肝素锂
肝素在血液中的浓度应在10IU/ml-30IU/ml的范围内。
1.6.4 EDTAK2/分离胶
EDTA在血液中的浓度应为1.5mg/ml ~2.2mg/ml的范围内,分离胶重量应为0.6g~1.2g/支。
1.6.5添加剂及附加物
表1
|
添加剂及 附加物 |
添加量 | 比 重 | 效 果 |
|
促凝剂 |
(5uL±1uL)/ml 血液 |
/ |
30min以内血块收缩完全,离心后,血清清晰,无纤维蛋白挂壁,无溶血现象。 |
| 分离胶 | 0.6g-1.2g/支管 | 1.04-1.075 | 能将血液中的液体成分和固体成分有效分开。 |
| 分离胶/促凝剂 | 0.6g-1.2g/支管 | 1.04-1.075 | 30min后上机离心能将血液中的血清和血球分层,上面为血清,下面为血球,血清清晰,无纤维蛋白挂壁,无溶血现象。 |
1.6.6氟化钠/草酸钾
草酸钾在血液中的浓度应在1mg/ml-3mg/ml的范围内;氟化钠应在1mg/ml-4mg/ml的范围内。
1.6.7氟化钠/EDTA
EDTA在血液中的浓度应在1.2mg/ml-2.0mg/ml的范围内,氟化钠应在1mg/ml-4mg/ml的范围内。
1.7标志与标签
1.7.1不透明标签不应完全包围管体。
1.7.2产品在规定的储存条件下,采集容器上的标志与标签应在其有效期内保持附着。
1.7.3每个初包装上都在外部至少表明一下信息:
a)制造商名称或商标;
b)批号:
c)有效期,宜以年 月或年 月 日表示;
d)内装物说明,应包括以下:
公称液体容量或抽吸体积;
字母代码和/或产品名称和或/内装物说明;
“无菌”字样或按YY/T0466.1采用的正确的图形符号,如果制造商声
称未打开的采集容器内部或采集容器的任何内装物无菌。
“一次性使用”字样或按YY/T0466.1采用的正确的图形符号;
贮存要求。
1.7.4如果采集容器是专门用来检测某一物质的,则受此物质污染的最大限量应在标签、初包装上或在支持性资料中标明。
1.7.5如果采集容器有液体添加剂,其体积应在标签、初包装上或在支持性资料中标明。
1.7.6采集容器应有以下直接标注在管体或标签上的信息:
a)制造商名称或商标;
b)批号;
c)字母代码和/或产品名称和或/内装物说明;
d)有效期,宜以年 月或年 月 日表示;
e)公称液体容量或抽吸体积,标注在采集容器的适宜位置;
f)“一次性使用”字样或按YY/T0466.1采用的正确的图形符号;
g)充装指示;如果不可行,应在初包装上或在支持性资料中给出如何正确地充装采集容器的信息;
h)“无菌”字样或按YY/T0466.1采用的正确的图形符号,如果制造商声称未打开和未使用的采集容器内部或采集容器的任何内装物无菌。
1.8采集容器的识别
应通过YY0314-2021表1给出的添加剂和附加物的字母代码和/或内装物说明,以及/或者产品名称对采集容器进行标识。若有表1之外的添加剂和附加物,应通过添加剂说明和/或产品名称对采集容器进行标识。识别添加剂和附加物的推荐色标参见《YY0314-2021》附录F。
2、主要结构组成或者成分:
采集容器由透明玻璃试管或塑料(PET)试管、丁基胶塞、塑料盖帽、标签、
添加剂(如果有)和附加物 (如果有)组成。
3、适用范围:
与一次性使用血样采集针配套使用,主要用于临床检验血样采集。
七.禁忌症、注意事项、警示以及提示的内容:
1、禁忌症:无
2、注意事项:
2.1产品使用的对象:
本产品采集人体静脉血液标本时,必须由医疗机构中经培训的专业人士操作,所采血样用于临床检验与储存,不得用于其它用途。
2.2潜在的安全危害及使用限制:
2.2.1 安全危害:
a)操作不当:导致产品不能使用。
b) 采血量不足:导致检验结果不准。
c) 密封性失效:无法使用。
d)用后未销毁:造成环境污染。
2.2.2使用限制:
a.无菌:与软连接式一次性使用血样采集针配套使用,用于血样的采集、贮存。
b.非无菌:与防逆流血样采集针配套使用,用于血样的采集、贮存。
2.3产品在正确使用过程中出现意外时,对操作者、使用者的保护措施以及应当采取的应急和纠正措施:
玻璃制品都有可能破损,为了防止采血管在使用时发生破损,使用者应带手套、穿长衣等保护用具,如采血管在使用时发生破损,应及时用酒精或消毒液在染上血液的地方大面积消毒。
2.4必要的监视、评估、控制:
2.4.1监视:生产厂家严格按照生产工艺进行生产,并进行成品抽检,保证出厂的产品合格。真空采血管的使用人员应在专业人员的指导下使用,防止造成产品无法使用。
2.4.2评估:真空采血管经过严格的生产工艺生产,并经过生产过程检验及成品检验,使用安全。
2.4.3为了控制真空采血管在使用时发生不必要的危害,请详细阅读说明书,按说明书的方法使用。
2.5本产品是一次性使用,用后销毁;无菌产品采用辐照灭菌,内腔无菌。
2.6与软连接式一次性使用血样采集针配套使用。
2.6.1要求
产品应无菌,一次性使用;
2.6.2使用方法
用消毒棉签清洁将要被采血的静脉部位,确认包装无破坏后,打开包装,取出一次性使用血样采集针,通过血样采集针一端穿刺静脉血管,一端由管塞穿刺针穿刺一次性使用人体静脉血样采集容器,由负压原理,自动采集血液样本。
2.6.3注意事项:
a)包装破损、保护套脱落,禁止使用;
b)只限一次性使用,用后销毁;
c)使用前先检查小包装是否漏气,小包装破损或漏气,禁止使用。
2.7采血针中瓶塞穿刺针上乳胶套用于防止滴血,采血时不能拔下;
2.8产品使用中可能存在的不良事件
2.8.1采血时如发现逆流,立刻拔掉采血管,停止抽血;
2.8.2采血时发现负压不足,应立即拔掉采血管,重新抽取。
2.9医疗器械废弃处理时,应有专业的医疗机构处理。
3、警示:
3.1医护人员在进行血液采集、血液分析和血液传递过程中,应带手套、穿长衣等保护用具,防止血液溅到或泄露到身上,避免血液感染。
3.2玻璃制品都有可能破损,在使用前应检查是否已破损。
4、提示:
4.1 高海拔地区请使用高海拔地区专用真空采血管,若使用普通真空采血管会导致采血量不足影响检验结果。
4.2本产品与一次性使用血样采集针配套使用。使用软连接式采血针进行首管采血时,由于其软管内腔体积较大会消耗一部分采血管的真空度,从而降低其采集量,所以本产品预制真空时已考虑软管内滞留液体积。滞留液体积与软管内径、长度等因素有关,例如:某厂家7#软连接式采血针的软管长度为170mm、内径为0.75mm时,经测量其滞留液体积约为0.35ml,但需注意不同厂家、不同规格、不同批号的采血针其滞留液体积会有差异。
4.3本公司真空采血管均有预留采集针所消耗的真空,请使用软连接式采集针抽血。如有抽样检验,应联系厂家提供配套的采集针。
4.3 回流的预防:
a.将患者手臂处于一个向下的姿势,上臂高于前臂。
b.采用蝶型针,保持真空采血管向上。
c.血液一旦开始流入真空采血管就松开止血带。
d.确保在静脉穿刺过程中真空采血管添加剂不会接触到针头的后端。
八.使用说明:
1、采血步骤:
1.1对采血部位进行皮肤消毒,待消毒溶液自然干燥后,将采集针管刺入血管,见回血后将采集针管穿透采集容器。由于采集容器的负压作用,血液自动流入采集容器内。
1.2采血时取下驱血带.采取的血液避免接触采血针吐出的部分,以防逆流。
1.3当管内真空消失,血液便停止吸入,拔下试管上的集血针管,若继续采集样本时,将集血针管刺入所需的采集容器,达到多管血样采集。
1.4采血后,将有添加剂的试管轻轻颠倒混匀6-8次,使添加剂与血液充分混匀。
2、检验项目:
2.1 无添加剂:适用于临床检验、血样采集、贮存。主要用于生化、免疫、血清等检验血液样本的采集。
2.2 促凝剂:适用于临床检验、血样采集、贮存。主要用于生化、免疫、血清等检验血液样本的采集。
2.3 分离胶/促凝剂:适用于临床检验、血样采集、贮存。主要用于生化、免疫、血清等检验血液样本的采集。
2.4 肝素钠:适用于临床检验、血样采集、贮存。主要用于快速血浆生化、血流变检测。
2.5 肝素锂:适用于临床检验、血样采集、贮存。主要用于快速血浆生化、血流变检测。
2.6 EDTAK2:适用于临床检验、血样采集、贮存。主要用于血液学血常规、全血检测。
2.7 EDTAK3:适用于临床检验、血样采集、贮存。主要用于血液学血常规、全血检测。
2.8柠檬酸钠9:1:适用于临床检验、血样采集、贮存。主要用于凝血机制
(PT、APTT、TT、凝血因子)检测。
2.9柠檬酸钠4:1:适用于临床检验、血样采集、贮存。主要用于血细胞沉降率检测。
2.10氟化钠:适用于临床检验、血样采集、贮存。主要用于血糖值的检测,能较长时间保持血液样本的原始性状。
2.11 EDTAK2/分离胶:适用于核酸检测。
九.储存运输:
1、储存:本产品应贮存在相对湿度不超过80%,温度0~35℃,无腐蚀性气体、通风良好清洁的室内。
2、运输条件:运输过程中禁止猛烈撞击,以免试管破裂,管内无负压,失去抽血作用。
十.生产日期及失效期:
生产日期及失效期详见中包装。
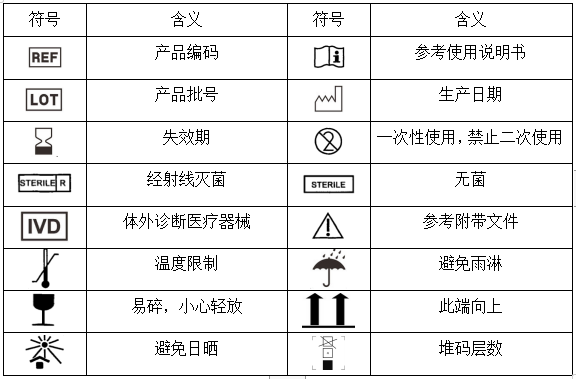
十一.医疗器械标签所用图形、符号、缩写等内容的解释:
十二.说明书的修订日期:
2022年10月10日
郑州山山医疗用品有限公司
